Genetik oder Mikrobiom

Prof. Dr. Stefan Schreiber*
Erbgut oder Bakterienbesiedelung – was davon ist für chronisch entzündliche Darmerkrankungen (CED) wie Morbus Crohn oder Colitis ulcerosa verantwortlich? Mag. Anita Frauwallner interviewt dazu Prof. Dr. Stefan Schreiber von der Christian-Albrechts-Universität zu Kiel, einen der bedeutendsten Forscher im Bereich der Gastroenterologie und einen beeindruckenden Arzt – spezialisiert auf Patienten mit chronisch entzündlichen Darmerkrankungen (CED). Der Experte erklärt den Zusammenhang zwischen Genetik und Mikrobiom und welche Bedeutung Probiotika in der Therapie haben können.
Mag. Anita Frauwallner: Sie beschäftigen sich in Forschung und Klinik intensiv mit chronisch entzündlichen Darmerkrankungen und deren Zusammenhang mit der Genetik. Was dürfen sich unsere Leser darunter vorstellen?
Prof. Dr. Stefan Schreiber: Das Spannende an den chronisch entzündlichen Darmerkrankungen ist, dass es diese vor dem Zweiten Weltkrieg praktisch nicht gab. Danach stieg die Krankheitshäufigkeit aber drastisch an und mündete darin, dass heute im Lauf des Lebens je nach Region bereits 0,5-1% der Bevölkerung davon betroffen sind. Die Zunahme dieser Krankheitsbilder kann aber eigentlich nichts mit der Genetik zu tun haben – denn unsere Gensequenz hat sich in den letzten 70 Jahren nicht verändert. Trotzdem kann man aus der Genetik wichtige Aufschlüsse über die Krankheitsursachen gewinnen.
Die Erforschung einer auf Ursachen gerichteten Therapie von entzündlichen Erkrankungen unterschiedlicher Art wird sich in naher Zukunft deutlich ändern. Entzündungen scheinen nämlich nur ein „Spätproblem“ zu sein, das auf die Störung der Darmbarriere folgt. In Zukunft wird es daher wichtig sein, nicht mehr nur die Entzündung zu therapieren, sondern direkt an den Epithelzellen der Darmschleimhaut anzusetzen und damit die Darmbarriere wiederherzustellen, zumal klassische entzündungshemmende Therapien auch das Mikrobiom verändern.
Mag. Frauwallner: Das menschliche Erbgut, das Genom, wurde im Jahr 2003 entschlüsselt, das ist also noch ein wirklich junges Forschungsgebiet. Gibt es trotzdem bereits Rückschlüsse für die Behandlung von entzündlichen Darmerkrankungen?
Prof. Schreiber: Es gibt einige Genvarianten, deren Träger ein erhöhtes Risiko haben, bestimmte Krankheiten auszubilden – bei chronisch entzündlichen Darmerkrankungen kann man aus diesen Genvarianten aber keine wirklich brauchbaren Rückschlüsse ziehen. Eines davon ist das sogenannte NOD2-Gen: Die Träger der Krankheitsvarianten dieses Gens haben zwar ein leicht erhöhtes Risiko, an einer CED zu erkranken, allerdings ist dieses so minimal, dass es für die Beratung eines erwachsenen Patienten nicht relevant ist. Bei Kindern hingegen macht es sehr wohl Sinn, sich das Genom genau anzusehen: Die frühe Ausprägung dieser „chronischen Volkskrankheiten“ sind deutlich stärker durch genetische Effekte verursacht. Identifiziert man die verantwortlichen Gene, kann auch die Ursache – und nicht nur das Symptom – therapiert werden.
Zum Einfluss des Mikrobioms auf Krankheiten ist mittlerweile eindeutig bewiesen, dass bestimmte Beschwerden ganz eindeutig mit einer veränderten, weniger leistungsfähigen Darmflora korrelieren.
Mag. Frauwallner: Bei den Erwachsenen sind es nun aber offensichtlich nicht die Gene alleine, denn nicht jeder, der ein Krankheitsgen in sich trägt, entwickelt eine chronisch entzündliche Darmerkrankung. Ihr Forschungsfeld liegt ja auch darin, zu ermitteln, welchen Einfluss unser Mikrobiom auf die Entwicklung von Krankheiten hat. Welche Erkenntnisse gibt es hier bereits?
Prof. Schreiber: Das ist ein besonders interessantes Feld, allein schon deswegen, weil es in den Bakterien, die unseren Darm besiedeln, ein Vielfaches mehr an Erbinformationen gibt als im Menschen selbst. Diese Besiedelung ist allerdings nicht dem Zufall überlassen: Es gibt nämlich sogenannte Enterotypen (= häufige Besiedelungsvarianten) – die man ein wenig mit den Blutgruppen vergleichen kann, d. h. das Mikrobiom ist nicht bei jedem Menschen in allen Bereichen unterschiedlich, sondern gewisse Bakterienstämme treten in bestimmten Kombinationen bei grossen Gruppen von Personen in ähnlichen Kombinationen auf.
Diese Enterotypen haben mit der Krankheit noch nichts zu tun, allerdings hängt deren Stabilität (auch: Resilienz) mit ihr zusammen: Das bedeutet, dass das Mikrobiom widerstandsfähig gegen Einflüsse von aussen ist, z. B. bei einer Antibiotikagabe: Über einige Zeit bringt ein Antibiotikum die Bakterienbesiedelung im Organismus komplett aus dem Gleichgewicht – ein resilientes Mikrobiom regeneriert sich jedoch wieder und gelangt im Idealfall in seinen Urzustand zurück.
Bezüglich des Einflusses des Mikrobioms auf Krankheiten ist mittlerweile eindeutig bewiesen, dass bestimmte Beschwerden ganz eindeutig mit einer veränderten, weniger leistungsfähigen Darmflora korrelieren.
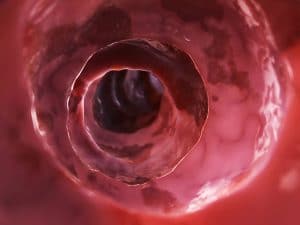
entzündete Darmwand
Die Frage, die sich nun stellt, ist, wie man die Leistungsfähigkeit des Mikrobioms misst. Ein ganz wesentlicher Massstab hierfür ist die Diversität, also ein Vorhandensein von vielen unterschiedlichen Organismen, die sich untereinander ergänzen. Von der Natur wissen wir, dass ein Ökosystem, z. B. der Wald, ein Zusammenspiel aus vielen unterschiedlichen Mikroorganismen ist, und eine Monokultur mit nur einer einzigen Pflanze auf Dauer nicht überlebensfähig wäre. Das Gleiche gilt für unsere Darmflora: Je mehr unterschiedliche Keime wir beheimaten, desto besser. Eine hohe Diversität schützt uns gegen pathogene Einflüsse von aussen, etwa gegen fremde Keime (die z. B. nach einer Antibiotikagabe oder über Nahrungsmittel in den Körper gelangen) oder gegen Infektionen.
Mag. Frauwallner: Das heisst also, dass eine veränderte Darmflora Krankheiten stark beeinflussen kann, aber dass auch unser Erbgut offensichtlich eine wichtige Rolle spielt. Gibt es bereits konkrete Erkenntnisse darüber, ob die Kombination aus einem geschädigten Mikrobiom mit bestimmten Genen Einfluss auf die Entwicklung von Krankheiten hat?
Prof. Schreiber: Ja. Das für mich eindrucksvollste Ergebnis dazu haben wir in einem Tiermodell mit zwei Gruppen von Mäusen gezeigt. In einer Gruppe wurde den Tieren ein bestimmtes Gen namens ATG16L1 entfernt. Wenn dieses Gen entfernt wird, gibt es im Verdauungstrakt keine der sogenannten Paneth-Zellen mehr. Diese Zellen sind unter anderem für die lokale Immunabwehr verantwortlich und helfen vermutlich auch dabei, die Unversehrtheit der Darmschleimhaut zu erhalten.
Beiden Tiergruppen wurden Antibiotika verabreicht, um die Darmflora zu stören und im Anschluss deren Resilienz, also die Widerstandfähigkeit und auch die Regenerationsfähigkeit, zu studieren.
Jene Mäuse, denen kein Gen entfernt worden war, erholten sich nach der Antibiotikagabe ausgezeichnet und bildeten in kurzer Zeit wieder eine normale Darmflora aus. Jene Gruppe jedoch, die kein ATG16L1-Gen mehr hatte (und damit eine eingeschränkte Immunabwehr im Darm), bildete nach der Einnahme des Antibiotikums so gut wie keine Diversität der Darmflora mehr aus.
Daraus ergibt sich natürlich eine wichtige Hypothese: Vielleicht existiert gar nicht die krankmachende Darmflora und vielleicht ist doch nicht die verminderte Diversität ausschlaggebend für die Entwicklung von Krankheiten, sondern vielleicht müssen wir vielmehr davon ausgehen, wie sehr sich die individuelle Darmflora – so gut oder schlecht sie sein mag – verändert und wieder erholt.
Mag. Frauwallner: Das haben Sie an identischen Zwillingspaaren untersucht, richtig? Soweit ich weiss, haben Sie die Darmflora von eineiigen Zwillingen untersucht, von denen je einer eine chronisch entzündliche Darmerkrankung hatte und der andere nicht. Was ist bei dieser spannenden Untersuchung herausgekommen?
Prof. Schreiber: Nur jeweils einer der Zwillinge hat trotz gleicher Genetik eine CED entwickelt. Woran liegt das? Auf den ersten Blick kann die Genetik anscheinend doch keine Rolle spielen, denn eineiige Zwillinge sind genetisch ja nahezu ident. Genauer betrachtet jedoch hat sich etwas äusserst Interessantes gezeigt:
Man kann untersuchen, wie gut die Darmflora in der Lage ist, die Informationen des menschlichen Erbgutes in den Zellen der Darmschleimhaut zu kontrollieren. Das heisst, einige definierte Bestandteile der Darmflora sind dafür verantwortlich, dass bestimmte Gene „abgelesen“ werden.
Bei jenen Zwillingen, die CED hatten, gab es diesen Zusammenhang aber nicht, d. h. das Zusammenspiel zwischen Darmflora und Genen war komplett aufgehoben. Im Vergleich dazu zeigte sich bei den kerngesunden Zwillingen, welche die Gene mit dem kranken Zwilling teilen, das gleiche Ergebnis: Auch hier war die Korrelation zwischen Mikrobiom und Genetik nicht gegeben.
Was bedeutet das jetzt für uns? Es gibt anscheinend eine ganze Reihe von Einflussfaktoren, von denen zwar keiner alleine für die Entwicklung einer CED verantwortlich ist, aber es zeigt sich eine eindeutige Entkoppelung von Genetik und Mikrobiom. Das bedeutet, dass künftig genetische Veranlagung und die Veränderung des Mikrobioms gleichermassen als Ursachen der Entstehung einer CED anzusehen sind. Auch scheint die genetische Diversität mit jener von unseren Darmbakterien zu korrelieren.
Was wir sicher wissen ist, dass die Veränderung des Mikrobioms vor der Manifestation der Darmerkrankung passiert. Wahrscheinlich gibt es bei der Geburt eine Metastabilität, die den Ausbruch der Krankheit zwar hinauszögert, aber durch äussere Einflüsse, z. B. durch Antibiotika, zusammenbricht. Wenn sich das Mikrobiom dann verändert, passiert das zufällig, d. h. es sind nicht immer die gleichen Bakterienstämme betroffen. Die Folge davon ist, dass der gesamte kooperative Metabolismus innerhalb des Mikrobioms und auch des Körpers gestört wird, das bedeutet, dass z. B. die Aufnahme und Verwertung von Nährstoffen in den Körper gestört ist.

Mag. Frauwallner: Was heisst das konkret für die Therapie von chronisch entzündlichen Darmerkrankungen? Inwieweit ist es sinnvoll, das Mikrobiom positiv zu beeinflussen, z. B. durch die Gabe von Probiotika?
Prof. Schreiber: Ein Therapieansatz, der das Mikrobiom bei bestimmten chronisch entzündlichen Darmerkrankungen zumindest im Ansatz „verbessern“ kann, ist tatsächlich die Gabe von Probiotika. Damit kann jedenfalls die Diversität erhöht werden. Derzeit gibt es mit Probiotika viele kleine Studien, eine Metaanalyse (also eine Analyse mehrerer Studien) zeigt einen Wirkungsvorteil gegenüber den Placebogruppen. Das Mikrobiom ist somit – obwohl die Forschung hier noch am Beginn steht – ein wichtiger Ansatzpunkt für die begleitende Therapie, und Probiotika sind sicher eine sehr gute Option.
Dieser Ansatz muss definitiv mit grossen Studien weiterverfolgt werden, um die Wirkung von Probiotika zu bestätigen. In Zukunft kann das Mikrobiom vielleicht auch als Biomarker dienen, auf dessen Basis Therapien gestaltet und deren Erfolg gemessen wird.
Mag. Frauwallner: Vielen Dank für dieses interessante Gespräch – wir freuen uns darauf, Teil dieser Forschungsarbeit zu sein!
*Prof. Dr. Stefan Schreiber ist Direktor der Klinik für Innere Medizin I und des Kompetenzzentrums Inflammation sowie am Institut für Klinische Mikrobiologie an der Christian-Albrechts-Universität zu Kiel tätig. Darüber hinaus ist er bereits seit mehreren Jahren Präsident der Deutschen Gesellschaft für Probiotische Medizin (DePROM).
Chronisch entzündliche Darmerkrankungen
Unter dem Begriff „chronisch entzündliche Darmerkrankungen“, kurz CED, werden alle Krankheitsbilder zusammengefasst, die durch schubweise wiederkehrende oder auch dauerhaft auftretende Entzündungen des Darms charakterisiert sind.
Morbus Crohn
Morbus Crohn ist gekennzeichnet durch unterschiedlich starke Entzündungen des Darms, wobei nicht nur die Schleimhaut (Mukosa), sondern auch tieferliegende Wandabschnitte des Darms davon betroffen sein können. Dadurch kann es zur Bildung von Geschwüren und/oder Engstellen kommen. Zudem können sich Verbindungsgänge (Fisteln) mit anderen Organen oder mit dem umgebenden Gewebe bilden.
Die Krankheit kann den gesamten Magen-Darm-Trakt vom Mund bis zum After betreffen, am häufigsten tritt die Erkrankung aber im letzten Abschnitt des Dünndarms (Ileum) sowie im ersten Abschnitt des Dickdarms auf. Typisch ist, dass gesunde und erkrankte Darmabschnitte abwechselnd vorhanden sind.
Colitis ulcerosa
Bei Colitis ulcerosa sind nicht alle Schichten der Darmwand, sondern nur die Darmschleimhaut (Mukosa) und die darunterliegende lockere Bindegewebsschicht (Submukosa) betroffen. In schweren Fällen kann es zur Ausbildung von Geschwüren kommen (Ulzerationen).
Die Krankheit verläuft meist schubweise und betrifft im Gegensatz zum Morbus Crohn fast ausschliesslich den Dickdarm, nur in seltenen Fällen ist auch der unterste Abschnitt des Dünndarms befallen. Typisch ist der Wechsel von Phasen mit blutigen Durchfällen und krampfartigen Bauchschmerzen bei der Stuhlentleerung, mit Zeiten, in denen es nur geringe oder keine Beschwerden gibt.